Indicador Ácido - Base
Indicadores
Algunas sustancias tienen la particularidad de presentar dos colores en sus formas ácido – base conjugadas, por lo que pueden utilizarse, ya sea para conocer aproximadamente si una solución es ácida o básica, o para determinar el punto final en una valoración ácido- base. Uno de los indicadores más conocidos es la fenolftaleína, que es incoloro en medio ácido y rosa en medio alcalino (se utiliza mucho en series como CSI). Muchas sustancias comunes como el té, vino tinto, extracto de flores y el repollo colorado presentan distintos colores según el pH del medio. Para poder utilizarlos como indicadores, es necesario investigar con ácidos o bases conocidas, que color toman. Tener en cuenta que los morados o violetas, como e lrepollo colorado o la campanilla -común en tejidos y cercas- presentan gran variación de colores según el grado de acidez o alcalinidad del medio (rojo,rosa, violáceo, azul, verde, amarillo)
Algunos ácidos y bases conocidos para poder probar si los indicadores funcionan:
Acidos: limón, vinagre, ácido muriático (usado en limpieza), gaseosas
Bases: productos de limpieza con amoníaco, limpiahornos, destapa cañerías, soda caústica (lejía), leche de magnesia.
Actividad: hervir repollo colorado y utilizar el agua coloreada como indicador para determinar el grado de acidez de productos de uso cotidiano.
Puede hacerse lo mismo con flores, machacando los pétalos con un poco de agua. Algunas de ellas, especialmente las moradas o rojas fuertes, presentan una gama interesante de colores según la acidez del medio. (probar con las alegrías del hogar).
Desde tiempos muy antiguos, se conocen distintas sustancias de origen orgánico que tienen la propiedad de cambiar su color, dependiendo de las características ácidas o básicas de las sustancias a las que son añadidas. En la actualidad, estas sustancias, y muchas otras, que se han introducido en el uso habitual de los laboratorios químicos, se utilizan con la finalidad de determinar el valor del pH de las disoluciones, así como también, el punto final de las valoraciones ácido –base. Dichas sustancias reciben el nombre de indicadores ácido-base.
Así podemos definir a un indicador ácido-base como, una sustancia que puede ser de carácter ácido o básico débil, que posee la propiedad de presentar coloraciones diferentes dependiendo del pH de la disolución en la que dicha sustancia se encuentre diluida.
Los indicadores presentan un comportamiento muy sencillo de comprender. Para realizar los ejemplos, supongamos a un indicador que está constituido por un ácido débil monoprótico con formula general Hln, de este modo, en una disolución acuosa se ionizará débilmente produciendo la base conjugada correspondiente ln^-.
Hln + H2O ↔ H3O^+ + ln^-
Fórmula ácida Fórmula básica
(Amarilla) (Azul)
Una característica de los indicadores es que la forma ácida (Hln) y la forma básica (ln^), tienen colores diferentes, por ejemplo, amarillo y azul, como en el caso de nuestro ejemplo. De las cantidades de una u otra forma que se encuentran presentes en la disolución, es de lo que depende el color de ésta.
Si se le añade a una disolución ácida HA, una pequeña cantidad de la disolución indicadora, se producen al mismo tiempo dos procesos, el equilibrio de ionización del indicador, y también el del ácido.
Hln + H2O ↔ H3O^+ + ln^-
HA + H2O ↔ H3O^+ + A^-
Cuando aumenta la concentración de [H3O^+], por efecto del ión común, el equilibrio que tiene el indicador se desplaza a la izquierda. En consecuencia, el color que predomina en la disolución será el color de la forma ácida, Hln.
Si añadimos una pequeña cantidad de indicador a una disolución básica:
Hln + H2O ↔ H3O^+ + ln^-
B + H2O ↔ BH^+ + OH^-
La concentración [H3O^+], se verá disminuida por la combinación de los iones H3O^+, con los iones OH^-, Y el equilibrio del indicador se ve afectado, desplazándose hacia la derecha. En consecuencia, dominará en la disolución el color de la forma básica ln^-
Cada uno de los indicadores posee un intervalo de viraje que lo caracteriza, es decir, un entorno en mayor o menor medida, reducido de unidades de pH. Dentro de dicho intervalo es donde se produce el cambio de color, o viraje. Un indicador tiene mayor utilidad, cuanto más pequeño es su intervalo de viraje, produciéndose así de forma más clara y sencilla el cambio de color.
En la tabla siguiente se muestran algunas indicadores ácidos-base, junto a los datos de sus intervalos de viraje y el color que tienen cuando el pH es menor o superior, a dicho intervalo.
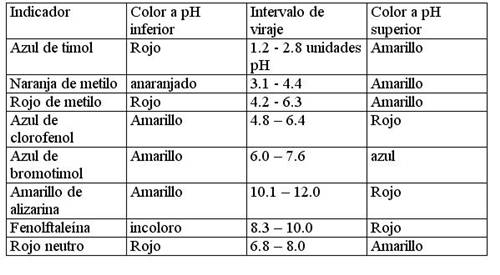
Ejemplo:
Pongamos como ejemplo el comportamiento del indicador azul de bromotimol, en tres soluciones diferentes: la solución ácida, neutra y básica.
- Al añadir nuestro indicador azul de bromotimol, en un tubo de ensayo que contenga una disolución de HCl por ejemplo, veremos un color amarillo en la solución, que tendrá un pH < 6.0.
- Si añadimos el mismo indicador a otro tubo de ensayo, esta vez relleno de agua, veremos que tendrá una coloración verde, con un pH= 7.
- Por último, cuando añadimos el indicador de azul de bromotimol, a un tubo de ensayo que contenga una disolución de NaOH, veremos como ésta se tiñe de azul, con un pH > 7.6. Se comprueba de este modo que el intervalo de viraje está entre 6.0 y 7.6.
El papel indicador universal, es gran utilidad en los laboratorios para poder medir de manera muy sencilla los diferentes pH de las disoluciones. Su manejo es extremadamente sencillo, pues basta con introducir un trocito de papel en la disolución problema, y éste inmediatamente mostrará un color determinado, que puede ir desde el rojo al azul, dependiendo si es ácida o básica.
|
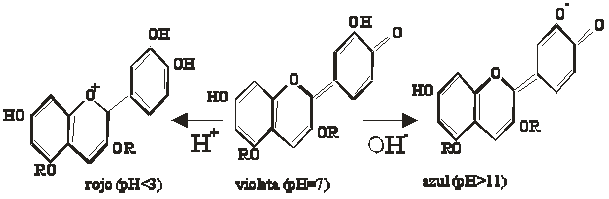
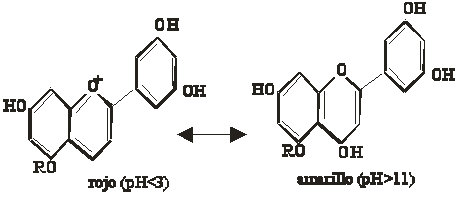
Indicadores químicos ácido-base. Un indicador químico es un ácido o base débil cuya forma disociada tiene diferente color que la forma sin disociar [5] , ello es debido a que están formados por sistemas resonantes aromáticos, que pueden modificar la distribución de carga según la forma que adopten. Esta alteración por el desplazamiento hacia una forma mas o menos disociada, hace que la absorción energética del sistema se modifique y con ello el color.
Se podría establecer un equilibrio de disociación para una forma de indicador ácido HIn: HIn X In- + H+ Color A Color B
La aplicación de la ley de acción de masas a este equilibrio, nos da que:
Si el medio es ácido, y aumenta la concentración de H+, deberá disminuir la relación [In-]/[HIn]. Para ello el equilibrio tendrá que desplazarse hacia la izquierda, aumentando la concentración de HIn, y dominando su color. Si el medio es básico, el cociente tendrá que aumentar, desplazándose el equilibrio hacia la derecha y dominando el color B. Naturalmente como se trata de un equilibrio, coexisten las dos formas, y por ello el color que toma procede de la mezcla de colores y de su proporción. Como los indicadores tienen diferentes constantes de equilibrio, por eso cambian de color en distintos intervalos de pH, esto suelo ocurrir aproximadamente a pH=pK"1 . Cuando coexisten varios equilibrios entre formas tautómeras, hay varios pK, y por lo tanto más de un cambio de color. Indicadores químicos ácido-base naturales. Se deben fundamentalmente a la proporción que contengan de los pigmentos naturales conocidos como antocianinas y antoxantinas. La antocianina es roja en medio ácido, púrpura en medio neutro y azul en medio básico, sin embargo la antoxantina es amarilla en medio básico. La proporción en que se encuentre la mezcla de pigmentos hace que las flores tengan distintos colores y que se puedan modificar según el pH del medio. Son glucósidos, con estructura parecida, modificándose la posición de determinados grupos hidroxilo, con carácter ácido, que según el medio producen diferentes formas encuadradas en una tautomería ceto-enólica. De su hidrólisis se extraen los pigmentos coloreados, las antocianidinas y antoxantidinas Así la forma más genérica de las antocianidinas, y su transformación sería (fig.1): |
|||||||||||||||||||||||
|
Fig.1 |
|||||||||||||||||||||||
|
Mientras que para las antoxantidinas, sería (fig.2): |
|||||||||||||||||||||||
|
Fig.2 |
|||||||||||||||||||||||
|
|
|||||||||||||||||||||||
|
La mayoría de los pétalos de las flores contienen ambos pigmentos, por eso en medio ácido el jarabe de violetas producía color rojo, mientras que en medio básico era verde, combinación del amarillo y del azul, tal como se muestra en la simulación (fig.3). Si domina más la concentración de amarillo, será verde amarillento. |
|||||||||||||||||||||||
Indicador de pH
Un indicador de pH es una sustancia que permite medir el pH de un medio. Habitualmente, se utilizan como indicador de las sustancias químicas que cambian su color al cambiar el pH de la disolución. El cambio de color se debe a un cambio estructural inducido por la protonación o desprotonación de la especie. Los indicadores Ácido-base tienen un intervalo de viraje de unas dos unidades de pH, en la que cambian la disolución en la que se encuentran de un color a otro, o de una disolución incolora, a una coloreada.
Los más conocidos son el naranja de metilo, que vira en el intervalo de pH 3,1 - 4,4, de color rojo a naranja, y la fenolftaleína, que vira desde un pH 8 hasta un pH 10, transformando disoluciones incoloras en disoluciones con colores rosados / violetas. Además se pueden usar indicadores caseros como la disolución resultante de hervir con agua col lombarda (repollo colorado), pétalos de rosa roja, raíces de cúrcuma a partir de las cuales se obtiene curcumina, y otros(entre los cuales podemos destacar a la col morada y la piel de ciruela, que son usadas por algunas culturas indígenas).
Los indicadores de pH tienen una constante de protonación,  , que informa sobre el desplazamiento de la reacción de protonación de la forma básica del indicador.
, que informa sobre el desplazamiento de la reacción de protonación de la forma básica del indicador.
![K=\frac{[H^+][I^-]}{[HI]} \,](https://upload.wikimedia.org/wikipedia/es/math/1/4/d/14d6e6257e8dd8496457f836fb2dbee9.png)
Se dice que el cambio de color de un indicador es apreciable cuando la concentración de la forma ácida o de la forma básica es superior o igual a 10 veces la concentración de la forma básica o la forma ácida respectivamente.
Papel tornasol
Este método es más barato, pero es más inexacto que los otros. Por eso se dice que este método es semicuantitativo, porque sólo muestra algo cercano a lo que es el pH de una disolución.
-
![\frac{[HI]}{[I^-]} \geq 10](https://upload.wikimedia.org/wikipedia/es/math/7/9/5/7956ae8f6fd6a60490f41542d1409699.png) ,
, ![\frac{[I^-]}{[HI]} \geq 10](https://upload.wikimedia.org/wikipedia/es/math/f/0/1/f01ff0ba937869ee7a51f82d88ba7c57.png)
Cuando la concentración de la forma ácida del indicador es igual a la concentración de la forma básica del indicador, la constante de protonación es igual a la inversa de la concentración de protones.
En este punto del pH, el color del indicador es una mezcla entre el color de la forma ácida y el color de la forma básica. Para obtener solamente el color de la forma básica, se debería aumentar 10 veces la concentración de la forma básica respecto a la de la ácida, según lo dicho antes, y para obtener el color de la forma ácida, se debería aumentar 10 veces la concentración de la forma ácida respecto a la de la básica. Con esto se tiene que el cambio de color de una forma a otra equivale a un factor de 100. Hablando en términos logarítmicos, equivale a 2 unidades de pH. Por tanto, la zona de viraje de un indicador suele estar entre una unidad por arriba y una por abajo de su  .
.
En resumidas cuentas, el papel pH, o papel tornasol, se vuelve rojo al mezclarse con ácidos y azul al mezclarse con sustancias básicas o alcalinas.

 , de lo que
, de lo que  .
.


![K=\frac{[HI]}{[H^+][I^-]} \Rightarrow [HI]=[I^-] \Rightarrow K=\frac{[HI]}{[H^+][HI]}=\frac{1}{[H^+]}](https://upload.wikimedia.org/wikipedia/es/math/8/b/4/8b45001e40e19fe654197468b7f07b33.png)